당신은 주제를 찾고 있습니까 “이온 반 경비 – 20150326 재료과학1“? 다음 카테고리의 웹사이트 https://kk.taphoamini.com 에서 귀하의 모든 질문에 답변해 드립니다: https://kk.taphoamini.com/wiki. 바로 아래에서 답을 찾을 수 있습니다. 작성자 OCW-HYU 이(가) 작성한 기사에는 조회수 99회 및 좋아요 1개 개의 좋아요가 있습니다.
Table of Contents
이온 반 경비 주제에 대한 동영상 보기
여기에서 이 주제에 대한 비디오를 시청하십시오. 주의 깊게 살펴보고 읽고 있는 내용에 대한 피드백을 제공하세요!
d여기에서 20150326 재료과학1 – 이온 반 경비 주제에 대한 세부정보를 참조하세요
이온 반 경비 주제에 대한 자세한 내용은 여기를 참조하세요.
4 th rule : 배위다면체의 연결 (2) 다른 양이온을 가진 결정에서는 …
원자 (이온) 반경은 원자핵의 크기와 전자의 수에 의존한다. … 음이온 반경의 합으로 주어지며 양이온의 배위수는 양이온과 음이온의 이온 반경비에 의해 결정된다.
Source: newcms.kmu.ac.kr
Date Published: 2/5/2022
View: 3112
4-2. 이온 반경과 배위수 – KorEArtH NET
원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대…
Source: www.korearth.net
Date Published: 10/14/2021
View: 7017
원자의 충전_폴링의 법칙
위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 … 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경 …
Source: depletionregion.tistory.com
Date Published: 11/24/2022
View: 130
Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number
1 Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN 이온(양이온 또는 음이온)의 가상 반경(크기) 결합 거리로부터 계산된 값 CN 하나 …
Source: slidesplayer.org
Date Published: 10/8/2021
View: 3290
The Crystal Structure of Materials
그림 2-9 배위수가 4인 경우 양이온과 음이온의. 반경 비에 따른 이온의 기하학적인 배열. The critical radius ratio is. If the radius ratio is less than this, ion A …
Source: contents.kocw.or.kr
Date Published: 6/2/2022
View: 995
주제와 관련된 이미지 이온 반 경비
주제와 관련된 더 많은 사진을 참조하십시오 20150326 재료과학1. 댓글에서 더 많은 관련 이미지를 보거나 필요한 경우 더 많은 관련 기사를 볼 수 있습니다.
주제에 대한 기사 평가 이온 반 경비
- Author: OCW-HYU
- Views: 조회수 99회
- Likes: 좋아요 1개
- Date Published: 2016. 8. 1.
- Video Url link: https://www.youtube.com/watch?v=8klBh_5GYb0
이온 반 경비 | 20150326 재료과학1 최근 답변 50개
당신은 주제를 찾고 있습니까 “이온 반 경비 – 20150326 재료과학1“? 다음 카테고리의 웹사이트 https://you.dianhac.com.vn 에서 귀하의 모든 질문에 답변해 드립니다: https://you.dianhac.com.vn/blog. 바로 아래에서 답을 찾을 수 있습니다. 작성자 OCW-HYU 이(가) 작성한 기사에는 조회수 84회 및 좋아요 1개 개의 좋아요가 있습니다.
여기에서 이 주제에 대한 비디오를 시청하십시오. 주의 깊게 살펴보고 읽고 있는 내용에 대한 피드백을 제공하세요!
이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; 결합 거리로부터 계산된 값. CN. Ch.4. 결정화학 …
+ 여기에 표시
Source: toplist.avitour.vn
Date Published: 3/11/2022
View: 4776
위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 … 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경 …
+ 여기에 자세히 보기
Source: depletionregion.tistory.com
Date Published: 3/2/2021
View: 1896
그림 2-9 배위수가 4인 경우 양이온과 음이온의. 반경 비에 따른 이온의 기하학적인 배열. The critical radius ratio is. If the radius ratio is less than this, ion A …
+ 여기에 보기
Source: contents.kocw.or.kr
Date Published: 6/7/2021
View: 5047
22:10. – 배위수 이온반경비. Ch.4. 결정화학. 이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; …
+ 여기에 보기
Source: dumbulling.tistory.com
Date Published: 2/16/2021
View: 9232
원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대…
+ 여기에 자세히 보기
Source: www.korearth.net
Date Published: 9/27/2021
View: 6385
원자 (이온) 반경은 원자핵의 크기와 전자의 수에 의존한다. … 음이온 반경의 합으로 주어지며 양이온의 배위수는 양이온과 음이온의 이온 반경비에 의해 결정된다.
+ 더 읽기
Source: newcms.kmu.ac.kr
Date Published: 6/14/2021
View: 5523
1 Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN 이온(양이온 또는 음이온)의 가상 반경(크기) 결합 거리로부터 계산된 값 CN 하나 …
+ 더 읽기
Source: slidesplayer.org
Date Published: 7/7/2022
View: 886
이온의 크기가 음이온과 같거나, 보다 클 대에는 12배위가 된다. 그러나 다른 요인으로 이 범위를 벗어나는 일이 발생하기도 하나, 일반적으로 이온반경비로부터 예상 …
+ 여기에 표시
Source: www.reportshop.co.kr
Date Published: 3/4/2022
View: 5655
주제와 관련된 더 많은 사진을 참조하십시오 20150326 재료과학1. 댓글에서 더 많은 관련 이미지를 보거나 필요한 경우 더 많은 관련 기사를 볼 수 있습니다.
20150326 재료과학1
20150326 재료과학1
KorEArtH NET
Article author: www.korearth.net
Reviews from users: 8436 Ratings
Ratings Top rated: 4.4
Lowest rated: 1
Summary of article content: Articles about KorEArtH NET 원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대… …
Most searched keywords: Whether you are looking for KorEArtH NET 원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대… gi 제 4장 2절, KorEArtH NET차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 지구화학 개론 – 제 4장 결정화학 (Crystal Chemistry) 4-1. 원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대…
Table of Contents:
KorEArtH NET
Read More
이온 반 경비
Article author: newcms.kmu.ac.kr
Reviews from users: 4763 Ratings
Ratings Top rated: 4.8
Lowest rated: 1
Summary of article content: Articles about 이온 반 경비 원자 (이온) 반경은 원자핵의 크기와 전자의 수에 의존한다. … 음이온 반경의 합으로 주어지며 양이온의 배위수는 양이온과 음이온의 이온 반경비에 의해 결정된다. …
Most searched keywords: Whether you are looking for 이온 반 경비 원자 (이온) 반경은 원자핵의 크기와 전자의 수에 의존한다. … 음이온 반경의 합으로 주어지며 양이온의 배위수는 양이온과 음이온의 이온 반경비에 의해 결정된다.
Table of Contents:
이온 반 경비
Read More
이온 반 경비
Article author: contents.kocw.or.kr
Reviews from users: 49933 Ratings
Ratings Top rated: 4.9
Lowest rated: 1
Summary of article content: Articles about 이온 반 경비 그림 2-9 배위수가 4인 경우 양이온과 음이온의. 반경 비에 따른 이온의 기하학적인 배열. The critical radius ratio is. If the radius ratio is less than this, ion A … …
Most searched keywords: Whether you are looking for 이온 반 경비 그림 2-9 배위수가 4인 경우 양이온과 음이온의. 반경 비에 따른 이온의 기하학적인 배열. The critical radius ratio is. If the radius ratio is less than this, ion A …
Table of Contents:
이온 반 경비
Read More
배위수 이온반경비 6 이온반경비 반경비 계산 4 이온반경비
Article author: dumbulling.tistory.com
Reviews from users: 17747 Ratings
Ratings Top rated: 3.5
Lowest rated: 1
Summary of article content: Articles about 배위수 이온반경비 6 이온반경비 반경비 계산 4 이온반경비 22:10. – 배위수 이온반경비. Ch.4. 결정화학. 이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; … …
Most searched keywords: Whether you are looking for 배위수 이온반경비 6 이온반경비 반경비 계산 4 이온반경비 22:10. – 배위수 이온반경비. Ch.4. 결정화학. 이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; … – 배위수 이온반경비 Ch.4. 결정화학. 이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; 결합 거리로부터 계산된 값. CN. Ch.4. 결정화학 이온원자 반경과 배위..
Table of Contents:
배위수 이온반경비 6 이온반경비 반경비 계산 4 이온반경비
Read More
원자의 충전_폴링의 법칙
Article author: depletionregion.tistory.com
Reviews from users: 40740 Ratings
Ratings Top rated: 3.6
Lowest rated: 1
Summary of article content: Articles about 원자의 충전_폴링의 법칙 위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 … 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경 … …
Most searched keywords: Whether you are looking for 원자의 충전_폴링의 법칙 위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 … 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경 … 정의상 가정 원자 사이 화학결합 내용상 가정 공식 단위 응용 격자(lattice) ↑파란 박스의 글자를 클릭하시면 가정과 응용으로 넘어 가실 수 있습니다!! 원자의 충전은 말 그대로 원자 사이에 화학..
Table of Contents:
‘물리학’ Related Articles
공지사항
검색
전체 방문자
최근 포스트
원자의 충전_폴링의 법칙
Read More
Access to this page has been denied.
Article author: www.studocu.com
Reviews from users: 44302 Ratings
Ratings Top rated: 3.0
Lowest rated: 1
Summary of article content: Articles about Access to this page has been denied. Updating …
Most searched keywords: Whether you are looking for Access to this page has been denied. Updating
Table of Contents:
Access to this page has been denied.
Read More
Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN – ppt download
Article author: slidesplayer.org
Reviews from users: 38719 Ratings
Ratings Top rated: 4.7
Lowest rated: 1
Summary of article content: Articles about Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN – ppt download Updating …
Most searched keywords: Whether you are looking for Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN – ppt download Updating l = 2r- d = 2r- + 2r+ d = √2 l r+/r- = CN이 왜 중요할까?Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN
Table of Contents:
Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN – ppt download
Read More
이온 반 경비
Article author: chemlab.pusan.ac.kr
Reviews from users: 18918 Ratings
Ratings Top rated: 4.7
Lowest rated: 1
Summary of article content: Articles about 이온 반 경비 특정한 배열이 선호되는 원인-이온반경 … Lattice: 결정에서 원자, 이온, 분자의 배열을 점의 배열로 나타냄. Lattice points는 asymmetric unit … 반경비: 0.414. …
Most searched keywords: Whether you are looking for 이온 반 경비 특정한 배열이 선호되는 원인-이온반경 … Lattice: 결정에서 원자, 이온, 분자의 배열을 점의 배열로 나타냄. Lattice points는 asymmetric unit … 반경비: 0.414.
Table of Contents:
이온 반 경비
Read More
See more articles in the same category here: https://toplist.avitour.vn/blog/.
KorEArtH NET
4-1. 원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대한 저항도 참고문헌 4-2. 이온 반경과 배위수 [그림 4-2-1] 베르너 하이젠버그 (1901-1976) 원자의 질량은 핵에 의해 결정되고, 크기는 전자에 의해 결정됨은 앞에서 설명한 바 있다. 그렇다면, 여기서 말하는 원자의 크기란 도대체 무엇일까? 그 것은 마치 당구공과 같이 전자가 핵 주위의 제한된 영역을 차지함으로써 원자가 일정한 공간을 항상 차지한다는 의미일까? 물론 그렇지 않다. 양자론의 기틀을 세우는데 매우 중요한 역할을 한 과학자중의 하나인 하이젠버그(Werner Heisenberg; 1901-1976)는 전자와 같이 작은 입자의 속도와 위치를 동시에 정확히 측정할 수 없다는 “불확정성의 원리(uncertainty principle)”를 수학적으로 증명하였다. 이 원리는 원자의 기술이 더 이상 보어(Bohr) 모델과 같은 뉴톤 물리를 사용할 수 없음을 의미하였으며, 그 대신 확률론에 근거한 양자론과 같은 전혀 새로운 체계의 수학적 기법의 도입이 필요함을 지시하였다. 이 불확정성의 원리에 따르면 전자가 정확히 어떠한 위치에 존재하는지 정할 수 없으며, 따라서 원자(또는 이온)의 크기 또한 정확히 측정할 수 없다. 그러므로, 원자의 실제크기 또는 이온의 실제 반경 같은 것은 없다고 보는 것이 타당할 것이다. [그림 4-2-2] 라이너스 폴링 (1901-1994) 그렇다면 여기서 얘기하는 원자의 크기 또는 이온 반경이란 무엇인가? 이 것은 분자 또는 결정을 구성하는 원자 또는 이온 핵 간의 거리를 바탕으로 계산된 가상의 크기인 것이다. 예를 들면, 염소 분자 Cl 2 의 염소 핵 간 거리를 측정한 후 이를 2로 나누고, 이를 염소의 반경으로 한다. 다음, 소금 결정 NaCl의 Na 핵 및 Cl 핵 간 거리를 측정한 후 이 거리에서 앞에서 계산된 염소의 반경을 빼고 난 값을 Na 이온의 반경으로 하는 식이다. 이와 같은 측정과 체계적인 자료정리는 최초 폴링(Linus Pauling; 1901-1994)에 의해서 시도되었는데, 이는 그가 결정 내 원자간 결합과 결정의 물리화학적 성질을 그의 VB (valence bond theory)로 보다 쉽게 설명하기 위해서였다. 비록, 이렇게 정해진 원자 또는 이온 반경들이 가상의 값이기는 하지만, 여러 결정 및 분자에서 마치 이들 원자와 이온들이 공 모양의 실제 크기를 갖는 것처럼 거의 일정한 값을 갖는 것이 알려졌고, 이를 이용해 분자 또는 결정의 구성 원소간 기하학적 분포와 치환에 대해 예측할 수 있음이 발견되었다. 이러한 이유로, 폴링 이후 많은 결정화학자들이 원자 및 이온의 반경을 보다 정확히 측정하려 노력하였으며, 이 과정에서 이들의 값이 결합 환경에 따라 조금씩 다름이 보다 명확하게 알려졌다. 현재 가장 많이 사용하는 원자 및 이온 반경의 값은 쉐논(R.D. Shannon)이 1976년 Acta Crystallographica에 발표한 “원소들의 유효 이온 반경” 값들이다. 이 이온 반경들은 이온의 결합 환경에 따라 자세히 세분해서 기록되어 있다. Shannon의 이온 반경의 일부를 보려면 [여기]를 눌러보자. 우리는 흔히 양이온과 음이온이 결합하여 결정을 만든다고 생각한다. 이러한 생각은 완전히 맞는 것도 그렇다고 완전히 틀린 것도 아니다. 이에 대해서는 뒤에 좀 더 자세히 얘기하기로 하고 일단은 그와 같이 이온과 이온의 결합으로 결정 또는 고상이 만들어진다고 생각하자. 이 때 하나의 이온은 다른 종류의 이온들에 의해 둘러 쌓이는데, 이를 배위(coordination) 라 하고, 둘러 싸고 있는 이온들의 수를 배위수(coordination number) 라 한다. 배위수는 둘러 싸인 이온과 둘러 싼 이온 간의 크기 비율, 즉 이온반경비(ionic raius ratio 또는 간단히 radius ratio) 에 의해 정해진다. [그림 4-2-3] 팔면체의 경우 양이온 음이온 배위 예를 들어 보자. 만일, 양이온과 음이온이 결합하여 정팔면체 모양의 배위를 한다고 가정하자. 이 경우 정팔면체의 가운데를 수평으로 자르면 옆 그림 4-2-3과 같은 정사각형 모양의 단면을 얻을 것이다. 만일, 모든 구성 이온들이 정확하게 맞 물려서 서로 간에 조금의 빈틈도 없다면, 이 정사각형 변의 길이 ㅣ과 대각선 길이 d는 각각 l = 2r – , d = 2r – + 2r + (4-1) 과 같이 될 것이다. 여기서 r – 와 r + 는 각각 음이온과 양이온의 이온 반경이다. 정사각형의 한 변과 대각선의 길이는 또한 다음과 같은 관계를 갖는다: d = √2 l (4-2) 위 (4-1) 식과 (4-2) 식을 연립하면 다음과 같은 이온 반경비를 얻을 수 있다. r + /r – = 0.414 (4-3) 즉, 양이온이 음이온의 41.4% 정도의 크기를 가지면 양이온을 중심으로 여섯 개의 음이온이 둘러 싸 (배위수=6) 팔면체 형태의 기하학적 모양을 이룰 수 있다는 말이다. 이 때 주의할 것은 위에 계산된 양이온의 크기가 팔면체를 이루기 위한 최소 크기라는 것이다. 이 보다 양이온이 크면 음이온 간의 거리가 좀 더 멀어지면 되므로 싱관 없지만 만일 더 적으면 음이온 간의 전자 구름이 겹치면서 대단히 강력한 반발에너지를 내기 때문에 결정 구조가 불안정하게 되기 때문이다. 아래 표는 위와 같은 방식으로 계산된 이온반경비와 배위수, 그리고 이로 인한 배위의 기하학적 모양을 정리한 것이다. 이 이온 반경비와 그로 인한 배위수는 전하와 함께 구성 성분간의 치환 여부를 결정하는 가장 중요한 요소이다. [표 4-2-1] 이온 반경비에 따른 배위수 및 그 배위의 기하학적 모양 이온반경비 배위수 기하학적 모양 <0.155 2 직선 0.155-0.225 3 삼각형 0.225-0.414 4 사면체 0.414-0.732 4 사각형 0.414-0.732 6 팔면체 0.732-1.00 8 육면체 >1.00 12 육면체(edge-centered) 4-3. 화학 결합의 종류와 그에 따른 물리적 성질에 계속
배위수 이온반경비 6 이온반경비 반경비 계산 4 이온반경비
– 배위수 이온반경비 Ch.4. 결정화학. 이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; 결합 거리로부터 계산된 값. CN. Ch.4. 결정화학 이온원자 반경과 배위수 이때 중요한것이 배위수Coordination number, CN인데 이는 한 원자 위 그림에서 그림a의 배위수가 4이면 임계반경비는 이온A의 반지름을 원자의 충전_폴링의 법칙 IT 톺아보기 구조의 배위수coordination number 한 원자를 둘러싸는 가장 가까운 원자의 수는 12이며 원자 충진율atomic packing factor 원자구 모델을 가정했을 때, 단위정 내 재료과학 정리 #02 – 배위수 6 이온반경비 2D At i P ki. 2D Atomic Packing. C #= 4. C #= 6 . 배위수 coordination number, CN. • +, 이온 이온 반경비 변화에 따른 A와 B원자 배위의 기하학적 배열. 예 FCC 구조의 Cu 원자반지름 R = 0.128 nm, 원자량 A 즉 Na양이온의 반경이 0.095nm이고 Cl음이온의 반경이 0.18nm이므로 이온반경비는 0.527이고 이는 66, 44, 33, 22, 11이며 최대 배위수는 66 원자의 충전_폴링의 법칙 IT 톺아보기 결정화학. 이온원자 반경과 배위수Coordination Number CN. 이온반경 이온양이온 또는 음이온의 가상 반경크기; 결합 거리로부터 계산된 값. CN. 하나의 이온원자과 일차 직접 결합 0.4140.732, 4, tetragonal. 0.4140.732, 6, octahedral. Ch.4. 결정화학 이온원자 반경과 배위수 옆쪽에 비타옥 다나오 비치에서 상시 모여 출발합니다. 몽키호핑을 예약하신 손님들보다 작고 배 안에서 활동할 수 있는 반경이 보라카이 방카보다 협소합니다 보홀호핑투어 보홀몽키호핑 예약하고 시원한 선물 받으세요!! 가벼운 비에 방수가 가능해요. 또한 한번 충전으로 20시간까지 사용할 수 있어 충전이블루투스 버전 Bluetooth 5.0 사용반경 10 m 이내 연속 음악재생/통화시간 TWS 블루투스 이어폰 비교/가격/특징 싸게 사는 법 알아보아요♪ – 배위수 반경비 계산 배위수 coordination number. 상대적 크기 비에 따른 배위수CN. ※ 임계반경비critical radius ratio. ⇒ 안정성 음이온과 양 이온의 전하 중심이 일치. Unstable. 예 FCC 구조의 Cu 원자반지름 R = 0.128 nm, 원자량 A 위 그림에서 그림a의 배위수가 4이면 임계반경비는 이온A의 반지름을 같이 계산하면 최대 배위수가 88이 되며 이러한 배위수를 유지하며 충전 원자의 충전_폴링의 법칙 IT 톺아보기 그러므로, 원자의 실제크기 또는 이온의 실제 반경 같은 것은 없다고 보는 것이 타당할 아래 표는 위와 같은 방식으로 계산된 이온반경비와 배위수, 그리고 이로 인한 4 3.5 계산해보면 이온결합성 50%이하 이경우 Glass 잘됨 계산식 1exp{1/4χAχB이고 산소가 2개의 Metal과 결합하면 비가교산소NonBridging Oxygen NBO 비정질 재료 중간고사 이전 성질 계산 ex 질량밀도와 격자 간 상대적 크기. 3. 결정구조에서 최밀 충진면closepacked과 방향을 확인 4. 결정좌표계에서 면과 결정방향을 결정하기 위해 밀러 기계재료 3장 원자와 이온 배열 – 배위수 4 이온반경비 이온 반경과 배위수. 그림 421 베르너 하이젠버그 19011976. 원자의 질량은 핵에 의해 결정되고, 크기는 전자에 의해 결정됨은 앞에서 설명한 바 있다. 그렇다면 4 단위포당 원자수 → 4개. • 단위포당 . 원소의 최인접원자간 거리를 모두 배위수 12의 경우로 환산해 이온 반경비 변화에 따른 A와 B원자 배위의 기하학적 배열. 예 FCC 구조의 Cu 원자반지름 R = 0.128 nm, 원자량 A 이때 중요한것이 배위수Coordination number, CN인데 이는 한 원자 위 그림에서 그림a의 배위수가 4이면 임계반경비는 이온A의 반지름을 원자의 충전_폴링의 법칙 IT 톺아보기 구조의 배위수coordination number 한 원자를 둘러싸는 가장 가까운 원자의 수는입방의 대각선이 원자 반지름의 4배이므로 입방의 변모서리 길이 a와 원자 재료과학 정리 #02 가벼운 비에 방수가 가능해요. 또한 한번 충전으로 20시간까지 사용할 수 있어 충전이블루투스 버전 Bluetooth 5.0 사용반경 10 m 이내 연속 음악재생/통화시간 TWS 블루투스 이어폰 비교/가격/특징 싸게 사는 법 알아보아요♪
원자의 충전_폴링의 법칙
728×90 반응형 정의상 가정 원자 사이 화학결합 내용상 가정 공식 단위 응용 격자(lattice) ↑파란 박스의 글자를 클릭하시면 가정과 응용으로 넘어 가실 수 있습니다!! 원자의 충전은 말 그대로 원자 사이에 화학결합이 작용하여 쌓이는 모양입니다. 따라서 원자 사이 화학결합에 영향을 많이 받고 특히 결합이 방향성인지 비항향성인지에 따라 달라집니다. 원자 사이 화학결합에서 볼때 방향성 결합은 원자와 원자의 결합만 본다면 공유결합이 있었고 이는 결합각을 만족하면서 충전하고, 이렇게 결합되다보면 결합각이 정해집니다. 즉 결합다면체가 연결되면서 원자배열을 합니다. 반면 비방향성 결합에는 이온결합과 금속결합이 있고 이들은 구면 대칭에다가 결합각에 대한 제한이 없습니다. 크기가 다른경우에는 최대 충전을 위해 기하학적 조건에 따라 충전됩니다. 따라서 원자의 상대적인 크기에 따라 결정이 되고 원자 중심을 연결해서 만드는 배위다면체를 형성합니다. 그럼 좀더 세부적으로 방향성 결합을 먼저 보겠습니다. 원자에 대한 결합수와 결합각이 정해져 결합방향은 전자의 양자상태에 따라 결정되는데, 메탄 CH4나 다이아몬드 같은 걍우 혼성궤도를 가지게 되는데 이는 정사면체를 꼭지점으로 향하는 같은 강도의 4개의 결합으로 위 그림의 (a)와 같이 결합합니다. 이때 탄소와 같은 4족 원소인 Si, Ge, Sn 같은 원소도 혼성화로 4개의 동등한 결합을 만들고 정사면체의 꼭지점을 차지합니다. 다이아몬드는그림(a)와 같은 3차원 배열이 쭉 진행하여 그림(b)와 같은 구조를 만듦니다. 이때 탄소의 4개의 결합에 다른 원자가 붙으면 고분자나 생체 분자등을 만듦니다. 비방향성 결합의 경우 2가지로 나눌 수 있습니다. 같은 크기의 비방향성 결합과 다른 크기의 비방향성 결합. 같은 크기의 비방향성 결합은 금속결합에서 주로 나타나며, 다른크기의 비방향성 결합은 이온결합에서 주로 나타납니다. 둘다 공통적으로 단위체적당 결합 에너지를 최소ㅗ 하는 방법으로 이루어지며, 결합하나의 에너지는 음의 값을 가지므로 결합수를 증가시킬 수 록 전체 에너지는 더 큰 음의 값을 지니게 됩니다. 즉 결합에너지를 최소화 하는 방법은 단위 체적당 원자수가 최대로 충전한다는 것이고, 이 조밀 충전 방법에는 2가지가 있습니다. 위 그림 (a)는 육방 조밀 충전(hexagonal close-packing, HCP)이라 부르며 층별로 연속적인 적층이 이루어 집니다. 이차원 면으로 이루어진 1층을 A, 2층을 B라 할때 ABABABAB….로 저층이 됩니다. 그림(b)의 경우에는 입방 조밀 충전(cubic close-packing, CCP)라 부르고 면심입방(face-centered cubic, FCC)라고도 부릅니다. 이는 한 면 A가 중심인 구로 된 층에 B가 중심인 구의 층을 만들고 그 위에 다시 C가 구의 중심인 츠을 쌓습니다 ABCABCABCABC….. 이때 육방 조밀과 입방 조밀 충전은 최인점 원자가 12개이고 적층 순서가 다르다는 특징이 있습니다. 그림(c)는 체심입방구조(body-centered cubic, BCC)로 조밀충전구조는 아니지만 이것도 단위 부피에 많은 원자를 포함하는 구조중 하나입니다. 이것은 최인접 원자수가 8개입니다. 그럼 이러한 조밀충전을 해야한다는 관점에서 비방향성의 크기가 같은 원자간의 결합을 보겠습니다. 금속의 경우 모두 같은 크기의 비방향성 원자들로 결합이 됩니다. 금속은 사실 불활성 원소와 같이 꽉 채워진 전자배치와 전자구름을 가지는 데 이로인해 금속원자를 강구(hard sphere)로 간주하겠습니다. 그러면 위에서 보앗듯 육방조밀충전으로 쌓인다고 할때 아래의 그림과 같이 됩니다. 그림 (a)에서 2차원 평면에 그림(b)와 같이 사이사이에 충전되어서 한 구에는 윗면 3개, 아랫면 3개가 채워져 6개가 채워집니다. 따라서 같은 평면에 인접하고 있는 원자까지 계산하면 최인접 원자가 12개로 12개 조밀충전으로 볼 수 있습니다. 이와 같이 단위체적당 결합에너지를 최소로 하기위해 금속의 거의 대부분은 상온에서 면심입방이나 육방 조밀 충전을 가집니다. 그외 나머지는 위에서 본 체심입방구조(BCC)입니다. 예를들어 알칼리금속(Li, Na, K등)과 전이금속(Fe, Cr, W)가 체심입방구조를 가지는데 Li, Na의 경우에는 상온 상압에서는 체심 입방이고, 낮은 온도에서는 조밀충전구조가 됩니다. 반만 채워진 d궤도를 가진 전이금속의 경우 공유결합 성질이 있어 약간의 방향성 때문에 채움률이 조금 낮은 체심 입방을 가집니다. 이들은 당연히 강한 결합력을 녹는 점이 높고 변형이 어렵습니다. 참고로 이 원자가 부피안에 얼마나 충진되었는지를 나타내는게 원자 충진률(Atomic Packing Factor, APF)이고 단위 격자내의 원자의 부피/ 단위격자의 부피를 의미 합니다. 즉 APF가 낮다면 밀도가 낮은 것이고 융용점이 낮은것을 의미합니다. BCC를 생각해본다면, 단위격자 안에 총 원자가 2개 있고( ) 가장 작은 원자 반경의 가능성을 본다면 대각선으로 으로 (a는 격자 상수)를 계산한다면 68%가 나옵니다. FCC도 동일한 방법으로 74%가 도출됩니다. 그럼 다음으로 다른크기의 비방향성 결합 원자들의 충전을 보겠습니다. 보통 이런것은 이온결합에서 주로 나타나는데 대게 양성인 원자에서 전기적으로 음성인 원자로 전자가 이동하여 음이온보다 양이온이 큰 경향이 있습니다. 어찌됬건 양이온과 음이온 크기가 다른데, 이들을 크기가 다른 구로 간주하고 보겠습니다. 이때 중요한것이 배위수(Coordination number, CN)인데 이는 한 원자 주위의 인접 원자수입니다. 이 배위수가 최대로 커야 합니다. 위 그림에서 보듯 그림 (a)는 양성자의 크기가 적어 조금한 vibration 같은 에너지가 작용해도 여기 붙었다 적이 붙었다 해서 불안정합니다. 배위수도 작습니다. 반면 그림(b)와 (c)같은 경우 안정합니다. 이는 밖에 이온끼리 서로 접하면서 중심에 있는 이온과 접할때의 이온변경비(critical radius ratio)가 임계반경비 < 반경비 의 관계를 만족해야 안정합니다. 다시말해 밖의 이온들끼리 접하고 접한 이온들의 틈에 다른 이온이 접할때의 반경비 보다 두 이온의 반경비가 크면 안정하다는 것입니다. 위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 ,이온B의 반지름을 라 하면 는 나올수 있는 가장 작은 경우로 하고 는 접하는 이온과더한것의 관계를 이용해서 입니다. 그림 (b)의 경우에는 똑같은 원리로 모든 경우에 대해서 다 계산한 것이 위 왼쪽 그림의 표와 같습니다. 이는 배위수 기준으로 나누어놓았고 결정에서 가능한 배위수가 1, 2, 3, 4, 6, 8, 12이기 때문에 다음 배위수 밖에 없습니다. 임계반경비 보다 작으면 불안정, 이상이면 안정합니다. 그러나 반경비가 계속 커지면 어느순간 A가 커지면 B의 입장에서 안정한 반경비도 고려해야합니다. 즉 위그림 (a), (b), (c)까지 이온A가 쭉쭉 커져도 안정했지만, 너무커져 그림(d)의 상황으로 가면 이온B가 불안정 해집니다. 따라서 둘다 만족시키는 범위를 가져야합니다. 그 범위를 각각 구해보면 다음과 같고 이들의 교집합을 표현한것이 아래 그림(a)와 같습니다. 예를 들어 황화아연( )에서 Zn은 0.072nm, S는 0.184nm이므로 이온반경비는 0.072/0.184=0.391인데 이는 왼쪽표에서 배위수의 비가 1:1, 2:2, 3:3, 4:4까지 만족합니다. 이때 이온주위의 배위수는 최대로 되려는 경향이 있으므로 최대 배위수는 양이온과 음이온의 배위수 4:4가 됩니다. 즉 Zn과 S는 배위수를 4로 하면서 계속 충전을 하고 이는 아래 그림 (a)와 같이 되며 이를 스팔러라이트 구조라 합니다.(=징크블랜드 구조) 참고로 다이아몬드구조와 비슷해보이지만, 다이아몬드 구조는 동종원소 스팔러라이트구조는 이종원소라는 차이가 있습니다. 그림 (b)는 염화나트름(NaCl)인데 이것도 위와 같은 방법으로 알 수 있습니다. 즉 Na양이온의 반경이 0.095nm이고 Cl음이온의 반경이 0.18nm이므로 이온반경비는 0.527이고 이는 6:6, 4:4, 3:3, 2:2, 1:1이며 최대 배위수는 6:6이므로 두 이온이 배위수를 6개로 하면서 충전하여 이는 염화나트륨 구조가 됩니다. 그림(c)는 염화세슘(CsCl)으로 위와 같이 계산하면 최대 배위수가 8:8이 되며 이러한 배위수를 유지하며 충전됨을 알 수 있습니다. 이때 이 모양이 BCC와 비슷해보이지만 이는 이종원소이므로 Simple cubic이라 보아야합니다.(BCC는 동종원소) 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경비가 1로 두 이온의 배위수가 12이므로 적층 순서의 종류에 따라 면심 입방(FCC)이나 육방 조밀 충전(HCP)가 됩니다. 이제 두 이온의 비율이 같지 않을때를 보겠습니다. 먼저 아래 그림 (a)와 같이 화합물 AB2인 B원자의 수가 A원자의 2배인 경우를 보겠습니다. 이때는 2:1, 4:2, 8:4, 12:6으로 나뉩니다. 만약 A2B3의 경우에는 배위수의 비가 3:2, 6:4, 12:8로 나옵니다. 그림(b)를 참조하시면 좋습니다. 예를 들어 SiO2와 같은 경우에서도 Si의 이온반경이 0.041nm이고 산소음이온 반경이 0.135nm로 이온반경비가 0.304이어 제일 안정된 배위수는 양이온과 음이온의 배위수 4:2이며 Si이온에 대한 배위수는 4, 산소에대한 배위수는 2로 하며 계속 충전되어 아래 그림 (a)와 같은 형태를 만듦니다. 이는 특별히 트리스토발라이트(Cristobalite, SiO2)라 부릅니다. 그림(b)와 같은 경우 Al2O3인데 Al의 이온반경 0.052nm이고 산소음이온반경이 0.135nm이므로 이온반경이 0.3085nm이기 때문에 배위수는 3:2가 되고, Al이 6개의 산소로 둘러 쌓여있고 4개의 Al이온이 1개의 산소이온으로 둘러싸여있는 코런덤(Corundum)구조가 만들어집니다. 이때 실제 이온의 반경비에서 구한 배위수가 차이나는 경우 때문에 실제 배위수와 반경비에서 구한 배위수가 차이가나는 경우가 있습니다. 이와같이 6:3의 경우 TiO2가 있는데 Ti의 배위수가 6개씩, O의 배위수가 3개씩 하여 아래 그림과 같은 결정구조를 가집니다. 지금까지 한 이온들의 충전에 예외적인 것들이 있는데 이 예외들을 법칙으로 만들어 논것이 있습니다. 이것이 폴링의 법칙이고 제 5법칙 까지 있습니다. 제 1법칙은 지금까지 설명한 기본적인 법칙을 요약해 둔것입니다. 즉 폴링의 제 1법칙은 음이온으로 된 배위 다면체가 각 양이온 주위에 만들어 지며 이온의 배위는 이온 반경비에 의해 결정된다는 것입니다. 제 2법칙은 전기 음성도 법칙입니다. 즉 복잡한 화합물에서 전기 음성도를 맞추며 결합한다는 법칙으로 s가 음이온과 양이온 사이의 정전기적 결합강도라 하고, 가 양이온의 전하, z가 양이온 주위의 배위수라 할 때 를 만족하고 음이온 주위에 인접하고 있는 모든 양이온 결합 강도의 합의 반대 부호가 음이온 전하를 만족해야 한다는 것입니다. 예를들어 그림 (a)와 같이 BaTiO3에서 (perovskite 구조라 합니다.) Ba의 배위수는 12이고 Ti의 배위수는 6으로 이고 O주위에 Ba가 4개 Ti가 2개로 O의 결합강도는 입니다. 그림 (b)는 그 관계를 더 간단하게 나타낸 것입니다. 플링의 3법칙은 배위 다면체의 연결에서 두 음이온 다면체가 변이나 면을 공유하면 두 양이온의 반발력이 중가하여 계의 퍼텐셜에너지가 증가하므로 두 다면체가 꼭지점(corner), 변(edge), 면(face)의 우선순위로 서로 공유하면서 충전된다는 것입니다. 이때 꼭지점이라는 것은 결정구조에서 외각에 있는 원자하나를 의미합니다. 플링의 4법칙은 배위수가 작을 수록 양이온의 전하가 클수록, 꼭지점을 공유하려는 경향이 커진다는 이온결합의 충전을 설명하는 모든 방식입니다. 예를 들어 SiO2에서 비교적 큰 전하인 Si4+의 강한 상호 반발력으로 꼭지점을 공유하며 연결합니다. 폴링의 5법칙인 한 구조에서 구성 원소의 종류의 수를 가능한 적게 하려한다는 것입니다 많은 구성 원소 종류는 여러 크깅의 이온과 음이온 다면체를 한 구조에서 효율척으로 충전하기 어렵기 때문입니다. 그러면 이를 이용해 지각의 95%나 이루는 엄청나게 중요한 규산염(Silicate) SiO2의 구조를 보겠습니다. 먼저 가장 안정된 Si와 O주위의 배위수를 구해보면 4와 2 입니다. Si 주위에 배위수 4를 만족시키기 위해 꼭지점에 O가 위치하면 꼭지점을 공유하면서 충전하므로 SiO2가 사면체가 됩니다. 이 O를 충전하는 방식에 따라 여러가지 결정구조가 만들어지는데 사면체를 충전할때 사면체 사이에 공유하는 꼭지점수로 분류합니다. 그 분류는 아래 표와 같습니다. 공유 꼭지점 수가 최대로 4이면 3차원으로 계속 충전하고 앞서말한 크리스토발라이트 구조가 됩니다. 즉 사면체에 꼭지 산소 원자마다 다시 Si가 붙어 진행합니다. 위 오른쪽 그림과 같이 사면체 두개가 하나의 산소(꼭지점)를 공유하고 있습니다. 즉 산소가 두개의 사면체를 공유합니다.. 다시말해 모든 산소가 두개 사면체를 고유하는 것입니다. 반면 공유하는 꼭지점의 갯수가 0이면 떨어져있는 사면체가 되며 사면체에 다음원자가 결합하지 않습니다. 즉 위 그림의 왼쪽그림 사면체 상태가 홀로 존재합니다. 으로 O주위에 Si가 하나만 있으면 전기중성도를 만족하지 못해 꼭지점 수가 3개 이하인 규산염에는 다른 양이온이 첨가됩니다. 이외에 파이로규산염(pyrosilicate)으로 O/Si=3.5도 있으며, 메타규산염(metasilicate)로 O/Si=3인 것이 있다. 특히 이 메타규산염의 경우 위 그림과 같이 공유꼭지점의 수의 수치는 같으나, 서로 다른 모양을 형성할 수 있다. 위 그림은 공유꼭지점수가 5/2인 이중사슬규산염(double chain silicate)으로 O/Si의 비가 2.75이고 두 줄의 사슬로 구성될 수 있고 사면체가 2개 또는 3개의 꼭지점을 공유할 수도 있습니다. 공유 꼭지점수가 3개가 된다면 위 그림과 같이 O/Si의 비가 2.5인 판 규산염(sheet silicate)이 도출됩니다. 반응형 So you have finished reading the 이온 반 경비 topic article, if you find this article useful, please share it. Thank you very much. See more: 이온반경비 계산, 배위수 반경비 계산, 배위수 8 이온반경비, 배위수 4 계산, 임계반경비, 이온반지름비, 폴링의 법칙, Pauling 법칙
KorEArtH NET
4-1. 원자의 전자구조 – 주기율표
4-2. 이온 반경과 배위수
4-3. 화학 결합의 종류와 그에 따른 물리적 성질
4-4. 전기음성도와 이온결합성
4-5. 정출 순서와 풍화에 대한 저항도
참고문헌
4-2. 이온 반경과 배위수
[그림 4-2-1] 베르너 하이젠버그 (1901-1976)원자의 질량은 핵에 의해 결정되고, 크기는 전자에 의해 결정됨은 앞에서 설명한 바 있다. 그렇다면, 여기서 말하는 원자의 크기란 도대체 무엇일까? 그 것은 마치 당구공과 같이 전자가 핵 주위의 제한된 영역을 차지함으로써 원자가 일정한 공간을 항상 차지한다는 의미일까? 물론 그렇지 않다. 양자론의 기틀을 세우는데 매우 중요한 역할을 한 과학자중의 하나인 하이젠버그(Werner Heisenberg; 1901-1976)는 전자와 같이 작은 입자의 속도와 위치를 동시에 정확히 측정할 수 없다는 “불확정성의 원리(uncertainty principle)”를 수학적으로 증명하였다. 이 원리는 원자의 기술이 더 이상 보어(Bohr) 모델과 같은 뉴톤 물리를 사용할 수 없음을 의미하였으며, 그 대신 확률론에 근거한 양자론과 같은 전혀 새로운 체계의 수학적 기법의 도입이 필요함을 지시하였다. 이 불확정성의 원리에 따르면 전자가 정확히 어떠한 위치에 존재하는지 정할 수 없으며, 따라서 원자(또는 이온)의 크기 또한 정확히 측정할 수 없다. 그러므로, 원자의 실제크기 또는 이온의 실제 반경 같은 것은 없다고 보는 것이 타당할 것이다.
[그림 4-2-2] 라이너스 폴링 (1901-1994)그렇다면 여기서 얘기하는 원자의 크기 또는 이온 반경이란 무엇인가? 이 것은 분자 또는 결정을 구성하는 원자 또는 이온 핵 간의 거리를 바탕으로 계산된 가상의 크기인 것이다. 예를 들면, 염소 분자 Cl 2 의 염소 핵 간 거리를 측정한 후 이를 2로 나누고, 이를 염소의 반경으로 한다. 다음, 소금 결정 NaCl의 Na 핵 및 Cl 핵 간 거리를 측정한 후 이 거리에서 앞에서 계산된 염소의 반경을 빼고 난 값을 Na 이온의 반경으로 하는 식이다. 이와 같은 측정과 체계적인 자료정리는 최초 폴링(Linus Pauling; 1901-1994)에 의해서 시도되었는데, 이는 그가 결정 내 원자간 결합과 결정의 물리화학적 성질을 그의 VB (valence bond theory)로 보다 쉽게 설명하기 위해서였다. 비록, 이렇게 정해진 원자 또는 이온 반경들이 가상의 값이기는 하지만, 여러 결정 및 분자에서 마치 이들 원자와 이온들이 공 모양의 실제 크기를 갖는 것처럼 거의 일정한 값을 갖는 것이 알려졌고, 이를 이용해 분자 또는 결정의 구성 원소간 기하학적 분포와 치환에 대해 예측할 수 있음이 발견되었다. 이러한 이유로, 폴링 이후 많은 결정화학자들이 원자 및 이온의 반경을 보다 정확히 측정하려 노력하였으며, 이 과정에서 이들의 값이 결합 환경에 따라 조금씩 다름이 보다 명확하게 알려졌다. 현재 가장 많이 사용하는 원자 및 이온 반경의 값은 쉐논(R.D. Shannon)이 1976년 Acta Crystallographica에 발표한 “원소들의 유효 이온 반경” 값들이다. 이 이온 반경들은 이온의 결합 환경에 따라 자세히 세분해서 기록되어 있다. Shannon의 이온 반경의 일부를 보려면 [여기]를 눌러보자.
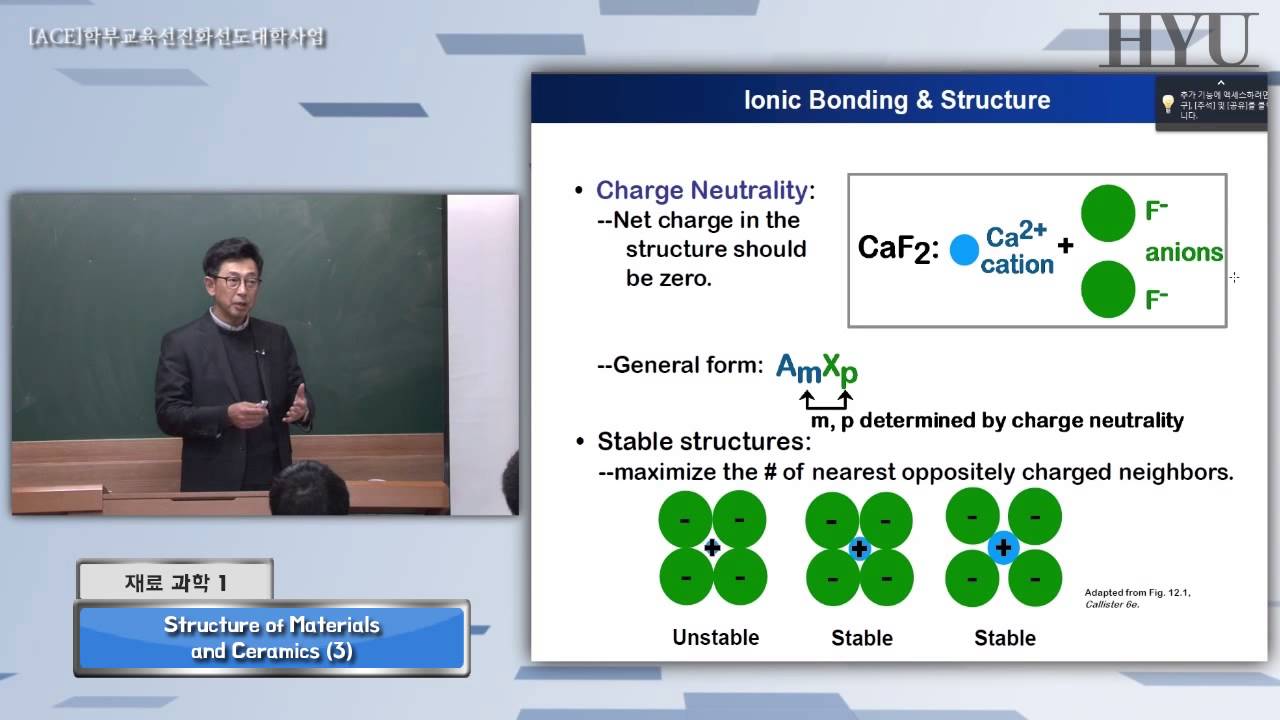
우리는 흔히 양이온과 음이온이 결합하여 결정을 만든다고 생각한다. 이러한 생각은 완전히 맞는 것도 그렇다고 완전히 틀린 것도 아니다. 이에 대해서는 뒤에 좀 더 자세히 얘기하기로 하고 일단은 그와 같이 이온과 이온의 결합으로 결정 또는 고상이 만들어진다고 생각하자. 이 때 하나의 이온은 다른 종류의 이온들에 의해 둘러 쌓이는데, 이를 배위(coordination) 라 하고, 둘러 싸고 있는 이온들의 수를 배위수(coordination number) 라 한다. 배위수는 둘러 싸인 이온과 둘러 싼 이온 간의 크기 비율, 즉 이온반경비(ionic raius ratio 또는 간단히 radius ratio) 에 의해 정해진다.
[그림 4-2-3] 팔면체의 경우 양이온 음이온 배위예를 들어 보자. 만일, 양이온과 음이온이 결합하여 정팔면체 모양의 배위를 한다고 가정하자. 이 경우 정팔면체의 가운데를 수평으로 자르면 옆 그림 4-2-3과 같은 정사각형 모양의 단면을 얻을 것이다. 만일, 모든 구성 이온들이 정확하게 맞 물려서 서로 간에 조금의 빈틈도 없다면, 이 정사각형 변의 길이 ㅣ과 대각선 길이 d는 각각
l = 2r – ,
d = 2r – + 2r + (4-1)
과 같이 될 것이다. 여기서 r – 와 r + 는 각각 음이온과 양이온의 이온 반경이다. 정사각형의 한 변과 대각선의 길이는 또한 다음과 같은 관계를 갖는다:
d = √2 l (4-2)
위 (4-1) 식과 (4-2) 식을 연립하면 다음과 같은 이온 반경비를 얻을 수 있다.
r + /r – = 0.414 (4-3)
즉, 양이온이 음이온의 41.4% 정도의 크기를 가지면 양이온을 중심으로 여섯 개의 음이온이 둘러 싸 (배위수=6) 팔면체 형태의 기하학적 모양을 이룰 수 있다는 말이다. 이 때 주의할 것은 위에 계산된 양이온의 크기가 팔면체를 이루기 위한 최소 크기라는 것이다. 이 보다 양이온이 크면 음이온 간의 거리가 좀 더 멀어지면 되므로 싱관 없지만 만일 더 적으면 음이온 간의 전자 구름이 겹치면서 대단히 강력한 반발에너지를 내기 때문에 결정 구조가 불안정하게 되기 때문이다.
아래 표는 위와 같은 방식으로 계산된 이온반경비와 배위수, 그리고 이로 인한 배위의 기하학적 모양을 정리한 것이다. 이 이온 반경비와 그로 인한 배위수는 전하와 함께 구성 성분간의 치환 여부를 결정하는 가장 중요한 요소이다.
[표 4-2-1] 이온 반경비에 따른 배위수 및 그 배위의 기하학적 모양이온반경비 배위수 기하학적 모양 <0.155 2 직선 0.155-0.225 3 삼각형 0.225-0.414 4 사면체 0.414-0.732 4 사각형 0.414-0.732 6 팔면체 0.732-1.00 8 육면체 >1.00 12 육면체(edge-centered)
4-3. 화학 결합의 종류와 그에 따른 물리적 성질에 계속
원자의 충전_폴링의 법칙
728×90
반응형
정의상 가정 원자 사이 화학결합 내용상 가정 공식 단위 응용 격자(lattice)
↑파란 박스의 글자를 클릭하시면 가정과 응용으로 넘어 가실 수 있습니다!!
원자의 충전은 말 그대로 원자 사이에 화학결합이 작용하여 쌓이는 모양입니다.
따라서 원자 사이 화학결합에 영향을 많이 받고 특히 결합이 방향성인지 비항향성인지에 따라 달라집니다.
원자 사이 화학결합에서 볼때 방향성 결합은 원자와 원자의 결합만 본다면 공유결합이 있었고 이는 결합각을 만족하면서 충전하고, 이렇게 결합되다보면 결합각이 정해집니다. 즉 결합다면체가 연결되면서 원자배열을 합니다.
반면 비방향성 결합에는 이온결합과 금속결합이 있고 이들은 구면 대칭에다가 결합각에 대한 제한이 없습니다. 크기가 다른경우에는 최대 충전을 위해 기하학적 조건에 따라 충전됩니다. 따라서 원자의 상대적인 크기에 따라 결정이 되고 원자 중심을 연결해서 만드는 배위다면체를 형성합니다.
그럼 좀더 세부적으로
방향성 결합을 먼저 보겠습니다.
원자에 대한 결합수와 결합각이 정해져 결합방향은 전자의 양자상태에 따라 결정되는데,
메탄 CH4나 다이아몬드 같은 걍우 혼성궤도를 가지게 되는데 이는 정사면체를 꼭지점으로 향하는 같은 강도의 4개의 결합으로 위 그림의 (a)와 같이 결합합니다. 이때 탄소와 같은 4족 원소인 Si, Ge, Sn 같은 원소도 혼성화로 4개의 동등한 결합을 만들고 정사면체의 꼭지점을 차지합니다.
다이아몬드는그림(a)와 같은 3차원 배열이 쭉 진행하여 그림(b)와 같은 구조를 만듦니다. 이때 탄소의 4개의 결합에 다른 원자가 붙으면 고분자나 생체 분자등을 만듦니다.
비방향성 결합의 경우 2가지로 나눌 수 있습니다. 같은 크기의 비방향성 결합과 다른 크기의 비방향성 결합.
같은 크기의 비방향성 결합은 금속결합에서 주로 나타나며, 다른크기의 비방향성 결합은 이온결합에서 주로 나타납니다.
둘다 공통적으로 단위체적당 결합 에너지를 최소ㅗ 하는 방법으로 이루어지며, 결합하나의 에너지는 음의 값을 가지므로 결합수를 증가시킬 수 록 전체 에너지는 더 큰 음의 값을 지니게 됩니다. 즉 결합에너지를 최소화 하는 방법은 단위 체적당 원자수가 최대로 충전한다는 것이고,
이 조밀 충전 방법에는 2가지가 있습니다.
위 그림 (a)는 육방 조밀 충전(hexagonal close-packing, HCP)이라 부르며 층별로 연속적인 적층이 이루어 집니다. 이차원 면으로 이루어진 1층을 A, 2층을 B라 할때 ABABABAB….로 저층이 됩니다.
그림(b)의 경우에는 입방 조밀 충전(cubic close-packing, CCP)라 부르고 면심입방(face-centered cubic, FCC)라고도 부릅니다. 이는 한 면 A가 중심인 구로 된 층에 B가 중심인 구의 층을 만들고 그 위에 다시 C가 구의 중심인 츠을 쌓습니다 ABCABCABCABC…..
이때 육방 조밀과 입방 조밀 충전은 최인점 원자가 12개이고 적층 순서가 다르다는 특징이 있습니다.
그림(c)는 체심입방구조(body-centered cubic, BCC)로 조밀충전구조는 아니지만 이것도 단위 부피에 많은 원자를 포함하는 구조중 하나입니다. 이것은 최인접 원자수가 8개입니다.
그럼 이러한 조밀충전을 해야한다는 관점에서
비방향성의 크기가 같은 원자간의 결합을 보겠습니다.
금속의 경우 모두 같은 크기의 비방향성 원자들로 결합이 됩니다. 금속은 사실 불활성 원소와 같이 꽉 채워진 전자배치와 전자구름을 가지는 데 이로인해 금속원자를 강구(hard sphere)로 간주하겠습니다. 그러면 위에서 보앗듯 육방조밀충전으로 쌓인다고 할때 아래의 그림과 같이 됩니다.
그림 (a)에서 2차원 평면에 그림(b)와 같이 사이사이에 충전되어서 한 구에는 윗면 3개, 아랫면 3개가 채워져 6개가 채워집니다. 따라서 같은 평면에 인접하고 있는 원자까지 계산하면 최인접 원자가 12개로 12개 조밀충전으로 볼 수 있습니다.
이와 같이 단위체적당 결합에너지를 최소로 하기위해 금속의 거의 대부분은 상온에서 면심입방이나 육방 조밀 충전을 가집니다.
그외 나머지는 위에서 본 체심입방구조(BCC)입니다. 예를들어 알칼리금속(Li, Na, K등)과 전이금속(Fe, Cr, W)가 체심입방구조를 가지는데 Li, Na의 경우에는 상온 상압에서는 체심 입방이고, 낮은 온도에서는 조밀충전구조가 됩니다.
반만 채워진 d궤도를 가진 전이금속의 경우 공유결합 성질이 있어 약간의 방향성 때문에 채움률이 조금 낮은 체심 입방을 가집니다. 이들은 당연히 강한 결합력을 녹는 점이 높고 변형이 어렵습니다.
참고로 이 원자가 부피안에 얼마나 충진되었는지를 나타내는게 원자 충진률(Atomic Packing Factor, APF)이고 단위 격자내의 원자의 부피/ 단위격자의 부피를 의미 합니다. 즉 APF가 낮다면 밀도가 낮은 것이고 융용점이 낮은것을 의미합니다.
BCC를 생각해본다면, 단위격자 안에 총 원자가 2개 있고( ) 가장 작은 원자 반경의 가능성을 본다면 대각선으로 으로 (a는 격자 상수)를 계산한다면 68%가 나옵니다. FCC도 동일한 방법으로 74%가 도출됩니다.
그럼 다음으로
다른크기의 비방향성 결합 원자들의 충전을 보겠습니다.
보통 이런것은 이온결합에서 주로 나타나는데 대게 양성인 원자에서 전기적으로 음성인 원자로 전자가 이동하여 음이온보다 양이온이 큰 경향이 있습니다. 어찌됬건 양이온과 음이온 크기가 다른데, 이들을 크기가 다른 구로 간주하고 보겠습니다.
이때 중요한것이 배위수(Coordination number, CN)인데 이는 한 원자 주위의 인접 원자수입니다. 이 배위수가 최대로 커야 합니다.
위 그림에서 보듯 그림 (a)는 양성자의 크기가 적어 조금한 vibration 같은 에너지가 작용해도 여기 붙었다 적이 붙었다 해서 불안정합니다. 배위수도 작습니다. 반면 그림(b)와 (c)같은 경우 안정합니다. 이는 밖에 이온끼리 서로 접하면서 중심에 있는 이온과 접할때의 이온변경비(critical radius ratio)가 임계반경비 < 반경비 의 관계를 만족해야 안정합니다. 다시말해 밖의 이온들끼리 접하고 접한 이온들의 틈에 다른 이온이 접할때의 반경비 보다 두 이온의 반경비가 크면 안정하다는 것입니다. 위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 ,이온B의 반지름을 라 하면 는 나올수 있는 가장 작은 경우로 하고 는 접하는 이온과더한것의 관계를 이용해서 입니다. 그림 (b)의 경우에는 똑같은 원리로 모든 경우에 대해서 다 계산한 것이 위 왼쪽 그림의 표와 같습니다. 이는 배위수 기준으로 나누어놓았고 결정에서 가능한 배위수가 1, 2, 3, 4, 6, 8, 12이기 때문에 다음 배위수 밖에 없습니다. 임계반경비 보다 작으면 불안정, 이상이면 안정합니다. 그러나 반경비가 계속 커지면 어느순간 A가 커지면 B의 입장에서 안정한 반경비도 고려해야합니다. 즉 위그림 (a), (b), (c)까지 이온A가 쭉쭉 커져도 안정했지만, 너무커져 그림(d)의 상황으로 가면 이온B가 불안정 해집니다. 따라서 둘다 만족시키는 범위를 가져야합니다. 그 범위를 각각 구해보면 다음과 같고 이들의 교집합을 표현한것이 아래 그림(a)와 같습니다. 예를 들어 황화아연( )에서 Zn은 0.072nm, S는 0.184nm이므로 이온반경비는 0.072/0.184=0.391인데 이는 왼쪽표에서 배위수의 비가 1:1, 2:2, 3:3, 4:4까지 만족합니다. 이때 이온주위의 배위수는 최대로 되려는 경향이 있으므로 최대 배위수는 양이온과 음이온의 배위수 4:4가 됩니다. 즉 Zn과 S는 배위수를 4로 하면서 계속 충전을 하고 이는 아래 그림 (a)와 같이 되며 이를 스팔러라이트 구조라 합니다.(=징크블랜드 구조) 참고로 다이아몬드구조와 비슷해보이지만, 다이아몬드 구조는 동종원소 스팔러라이트구조는 이종원소라는 차이가 있습니다. 그림 (b)는 염화나트름(NaCl)인데 이것도 위와 같은 방법으로 알 수 있습니다. 즉 Na양이온의 반경이 0.095nm이고 Cl음이온의 반경이 0.18nm이므로 이온반경비는 0.527이고 이는 6:6, 4:4, 3:3, 2:2, 1:1이며 최대 배위수는 6:6이므로 두 이온이 배위수를 6개로 하면서 충전하여 이는 염화나트륨 구조가 됩니다. 그림(c)는 염화세슘(CsCl)으로 위와 같이 계산하면 최대 배위수가 8:8이 되며 이러한 배위수를 유지하며 충전됨을 알 수 있습니다. 이때 이 모양이 BCC와 비슷해보이지만 이는 이종원소이므로 Simple cubic이라 보아야합니다.(BCC는 동종원소) 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경비가 1로 두 이온의 배위수가 12이므로 적층 순서의 종류에 따라 면심 입방(FCC)이나 육방 조밀 충전(HCP)가 됩니다. 이제 두 이온의 비율이 같지 않을때를 보겠습니다. 먼저 아래 그림 (a)와 같이 화합물 AB2인 B원자의 수가 A원자의 2배인 경우를 보겠습니다. 이때는 2:1, 4:2, 8:4, 12:6으로 나뉩니다. 만약 A2B3의 경우에는 배위수의 비가 3:2, 6:4, 12:8로 나옵니다. 그림(b)를 참조하시면 좋습니다. 예를 들어 SiO2와 같은 경우에서도 Si의 이온반경이 0.041nm이고 산소음이온 반경이 0.135nm로 이온반경비가 0.304이어 제일 안정된 배위수는 양이온과 음이온의 배위수 4:2이며 Si이온에 대한 배위수는 4, 산소에대한 배위수는 2로 하며 계속 충전되어 아래 그림 (a)와 같은 형태를 만듦니다. 이는 특별히 트리스토발라이트(Cristobalite, SiO2)라 부릅니다. 그림(b)와 같은 경우 Al2O3인데 Al의 이온반경 0.052nm이고 산소음이온반경이 0.135nm이므로 이온반경이 0.3085nm이기 때문에 배위수는 3:2가 되고, Al이 6개의 산소로 둘러 쌓여있고 4개의 Al이온이 1개의 산소이온으로 둘러싸여있는 코런덤(Corundum)구조가 만들어집니다. 이때 실제 이온의 반경비에서 구한 배위수가 차이나는 경우 때문에 실제 배위수와 반경비에서 구한 배위수가 차이가나는 경우가 있습니다. 이와같이 6:3의 경우 TiO2가 있는데 Ti의 배위수가 6개씩, O의 배위수가 3개씩 하여 아래 그림과 같은 결정구조를 가집니다. 지금까지 한 이온들의 충전에 예외적인 것들이 있는데 이 예외들을 법칙으로 만들어 논것이 있습니다. 이것이 폴링의 법칙이고 제 5법칙 까지 있습니다. 제 1법칙은 지금까지 설명한 기본적인 법칙을 요약해 둔것입니다. 즉 폴링의 제 1법칙은 음이온으로 된 배위 다면체가 각 양이온 주위에 만들어 지며 이온의 배위는 이온 반경비에 의해 결정된다는 것입니다. 제 2법칙은 전기 음성도 법칙입니다. 즉 복잡한 화합물에서 전기 음성도를 맞추며 결합한다는 법칙으로 s가 음이온과 양이온 사이의 정전기적 결합강도라 하고, 가 양이온의 전하, z가 양이온 주위의 배위수라 할 때 를 만족하고 음이온 주위에 인접하고 있는 모든 양이온 결합 강도의 합의 반대 부호가 음이온 전하를 만족해야 한다는 것입니다. 예를들어 그림 (a)와 같이 BaTiO3에서 (perovskite 구조라 합니다.) Ba의 배위수는 12이고 Ti의 배위수는 6으로 이고 O주위에 Ba가 4개 Ti가 2개로 O의 결합강도는 입니다. 그림 (b)는 그 관계를 더 간단하게 나타낸 것입니다. 플링의 3법칙은 배위 다면체의 연결에서 두 음이온 다면체가 변이나 면을 공유하면 두 양이온의 반발력이 중가하여 계의 퍼텐셜에너지가 증가하므로 두 다면체가 꼭지점(corner), 변(edge), 면(face)의 우선순위로 서로 공유하면서 충전된다는 것입니다. 이때 꼭지점이라는 것은 결정구조에서 외각에 있는 원자하나를 의미합니다. 플링의 4법칙은 배위수가 작을 수록 양이온의 전하가 클수록, 꼭지점을 공유하려는 경향이 커진다는 이온결합의 충전을 설명하는 모든 방식입니다. 예를 들어 SiO2에서 비교적 큰 전하인 Si4+의 강한 상호 반발력으로 꼭지점을 공유하며 연결합니다. 폴링의 5법칙인 한 구조에서 구성 원소의 종류의 수를 가능한 적게 하려한다는 것입니다 많은 구성 원소 종류는 여러 크깅의 이온과 음이온 다면체를 한 구조에서 효율척으로 충전하기 어렵기 때문입니다. 그러면 이를 이용해 지각의 95%나 이루는 엄청나게 중요한 규산염(Silicate) SiO2의 구조를 보겠습니다. 먼저 가장 안정된 Si와 O주위의 배위수를 구해보면 4와 2 입니다. Si 주위에 배위수 4를 만족시키기 위해 꼭지점에 O가 위치하면 꼭지점을 공유하면서 충전하므로 SiO2가 사면체가 됩니다. 이 O를 충전하는 방식에 따라 여러가지 결정구조가 만들어지는데 사면체를 충전할때 사면체 사이에 공유하는 꼭지점수로 분류합니다. 그 분류는 아래 표와 같습니다. 공유 꼭지점 수가 최대로 4이면 3차원으로 계속 충전하고 앞서말한 크리스토발라이트 구조가 됩니다. 즉 사면체에 꼭지 산소 원자마다 다시 Si가 붙어 진행합니다. 위 오른쪽 그림과 같이 사면체 두개가 하나의 산소(꼭지점)를 공유하고 있습니다. 즉 산소가 두개의 사면체를 공유합니다.. 다시말해 모든 산소가 두개 사면체를 고유하는 것입니다. 반면 공유하는 꼭지점의 갯수가 0이면 떨어져있는 사면체가 되며 사면체에 다음원자가 결합하지 않습니다. 즉 위 그림의 왼쪽그림 사면체 상태가 홀로 존재합니다. 으로 O주위에 Si가 하나만 있으면 전기중성도를 만족하지 못해 꼭지점 수가 3개 이하인 규산염에는 다른 양이온이 첨가됩니다. 이외에 파이로규산염(pyrosilicate)으로 O/Si=3.5도 있으며, 메타규산염(metasilicate)로 O/Si=3인 것이 있다. 특히 이 메타규산염의 경우 위 그림과 같이 공유꼭지점의 수의 수치는 같으나, 서로 다른 모양을 형성할 수 있다. 위 그림은 공유꼭지점수가 5/2인 이중사슬규산염(double chain silicate)으로 O/Si의 비가 2.75이고 두 줄의 사슬로 구성될 수 있고 사면체가 2개 또는 3개의 꼭지점을 공유할 수도 있습니다. 공유 꼭지점수가 3개가 된다면 위 그림과 같이 O/Si의 비가 2.5인 판 규산염(sheet silicate)이 도출됩니다. 반응형
Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN
We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
Buttons:
세라믹스 [ceramics]의 이해와 특성
이온의 크기가 음이온과 같거나, 보다 클 대에는 12배위가 된다. 그러나 다른 요인으로 이 범위를 벗어나는 일이 발생하기도 하나, 일반적으로 이온반경비로부터 예상되는 배위가 실제적이나, 기하학적으로 허용되는 하한의 이온반경에 가까울수록 안정한 물질이라고 할 수 있다. 배위수와 물성과는 밀
47페이지 | 2,200원 | 2010.01.17
이온반경비 계산 레포트
파일의 다운로드가 제대로 되지 않거나 파일형식에 맞는 프로그램으로 정상 작동하지 않는 경우
다른 자료와 70% 이상 내용이 일치하는 경우 (중복임을 확인할 수 있는 근거 필요함)
인터넷의 다른 사이트, 연구기관, 학교, 서적 등의 자료를 도용한 경우
자료의 설명과 실제 자료의 내용이 일치하지 않는 경우
키워드에 대한 정보 이온 반 경비
다음은 Bing에서 이온 반 경비 주제에 대한 검색 결과입니다. 필요한 경우 더 읽을 수 있습니다.
이 기사는 인터넷의 다양한 출처에서 편집되었습니다. 이 기사가 유용했기를 바랍니다. 이 기사가 유용하다고 생각되면 공유하십시오. 매우 감사합니다!
사람들이 주제에 대해 자주 검색하는 키워드 20150326 재료과학1
- 동영상
- 공유
- 카메라폰
- 동영상폰
- 무료
- 올리기
20150326 #재료과학1
YouTube에서 이온 반 경비 주제의 다른 동영상 보기
주제에 대한 기사를 시청해 주셔서 감사합니다 20150326 재료과학1 | 이온 반 경비, 이 기사가 유용하다고 생각되면 공유하십시오, 매우 감사합니다.
